EuroAtaxia Bericht 2018 Von Suni christie
EuroAtaxia Konferenz 2018 Frankfurt-am-Main
November letzten Jahres reiste ich zum dritten Mal für EuroAtaxia. Alles passiert auf englischer Sprache. Es liegt an mir, und ich bin kein Naturwissenschaftler, davon zu berichten. Auch für Wissenschaftler ändert und erweitert sich stets das Basisverständnis zu FriedA. In den Updates zu den NICOFA und MOXIE Projekten erkläre ich dieses Mal einiges zu FriedA. Es ist von keinem Wissenschaftler geprüft und ich lehne Verantwortung für die genaue Richtigkeit auf Deutsch ab.
Überblick
In 2016 berichtete ich über die Aktivitäten und Zielen von Massimo Pandolfo in Brüssel und von Jan Farmer bei FARA USA, die beide in eine Richtung führen: die Entstehung eines Europa- wie auch eines USA-weite, oder sogar eines welt-weite Patienten-Registers (auf Englisch, Patient Registry) für FriedA.(Siehe unten 2016).
Als Konferenz verknüpfte EuroAtaxia Frankfurt 2018 wieder ans Thema einer solchen Datenbank an, wie auch zu den als Phänomene immer-wichtigeren E-Dienste.
Wir bekamen einen Update zu EFACTS (European Friedreich’s Ataxia Consortium for Translational Studies) präsentiert von Jörg Schulz. Carola Reinhard berichtete zu ERN RND (European Reference Network for Rare Neurological Diseases), welches ein bereichs-übergreifendes Project ist, das sich mit den Daten von etwa 35.000 Betroffenen befasst. Cathalijne van Doorne berichtete über ihre Arbeit bei EURORDIS (European Organization for Rare Diseases).
Julie Greenfield, Ataxia UK, ergänzte diese eher medizinische Beiträge mit ihrer Präsentation zum ‘Value of Treatment Project – ataxia study’, einem sozial-wissenschaftlichen Projekt, das durch die Überlegungen bei ERN RND generiert wurde, und vom European Brain Council finanziert wird.
Die weitere Vorträge befassten sich mit, oder berichteten über, verschiedene(n) Aspekte der Arzneiforschung. Für uns von grösstem Interessewarenzwei potentielle Arznei-therapien für FriedA-betroffenen, die unmittelbar in Phase 3 der klinischen Versuchen vorbereitet werden: Kara Eichelkraut gab einen Update zu REATAs MOXIE Trials in Dallas Texas(!), und Prof Jörg Schulz zu den erweiterten Nicotinamid (Vitamin B3) Phase 3 Versuchen, die er jetzt in Aachen koordiniert.
In Detail
Carola Reinhard ,Tübingen, berichtete zu ERN RND
(Siehe:https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=en&Expert=482762)
EuropeanReference Network for Rare Neurological Diseases (Europäische Netzwerk für Seltene Neurologische Krankheiten)ist als Antwort auf EU-Direktiv 2011:24 ins Leben gerufen worden und macht klar, was durch Zusammenarbeit erreicht werden kann: es ist ein Art „big Data“ Projekt und ein Info-Hub, der vieles für viele anbietet.
Die Absichten sind Patientenzentriert: Das Netzwerk soll verbesserte Diagnosen und Therapien dienen. Als E-network kann es am besten als Informations-Hub beschrieben werden: es sammelt, koordiniert und verbreitet Wissen zu seltenen neurologischen Krankheiten und es verbindet Patienten, Ärzte, Pharma, Forschung und Regulatoren.
31 Mitglieder in 13 EU Länden sind dabei und teilen ihre partikulare Wissen und Praxen mit. Diese werden unter den Rubriken Clinical Guidelines(was tun),Healthcare pathways(wohin sich melden: Expertisen-zentren), Standardised scales of assessment(standardisierte Messungs-skalen) und Diagnostic algorithmskoordiniert und verbreitet. Ressourcen werden gebündelt um internationale Bildungs- und Weiterbildungs-workshops für Professionellen anzubieten. Gleichzeitig dient die Webseite betroffenen Einzelnen: Wir können die zugängliche Daten für virtuelle Gesundheits-infos und Versorgung benutzen. Als letzte dient das Netzwerk den Interessen der Forschungsindustrie: spezifische Patienten-kohorte mitsamt ihren Daten werden aus Patienten-registern zusammengestellt um reelle mögliche Versuchs-kohorten für konkreten Trials zu bilden.
Fazit: weil es zu konkreter Interaktion zwischen Patienten, Ärzten und anderen Fachkräften, Pharma-forschern, Pharma-business und Aufsichtsbehörden geführt hat, ist es möglich geworden, Bedürfnisse zu klären, Vereinbarungen zu treffen und diese in Handlungen verschiedene Arte umzusetzen (in der EU?).
Das Monitoring vom Wert dieses Hub wird durch die European Brain Council Value of Treatment projectgewährleistet.
Julie Greenfield, Ataxia UK und das European Brain Council Value of Treatment Project
Dr. Julie Greenfield, leitet dieses Projekt und berichtete auch davon.
Wir lesen von Projekten wie ERN RND und es scheint alles so kohärent und imponierend. Aber kommen solche Projekte zur Sache der eigenen oder allgemeinen subjektiven Erfahrung? Führt in der Tat das Teilen und die Verbreitung von Informationen zu einer früheren Diagnose, zu wirksamere Behandlungen und Therapien, und zu einer gesteigerten Lebensqualität bei Betroffenen und ihren Rund-um-kommunität? Ist das Geld eigentlich gut investiert?
Das ‘Value of Treatment project – ataxia study’ist ausgedacht, um solchen Fragen nachzugehen und zu beantworten. Der Team von Dr. Julie Greenfield, Head of Research,
Dr Julie Greenfield Head of Research at Ataxia UK bei ihrer Präsentation der Value of Treatment Projekt, das sie mit Prof Dr. Paula Giunti ausgedacht hat und führen. | Ataxia UK, und Prof. Dr. Paula Giunti, University College London, haben das Projekt vorbereitet: es ist angewandt und komparativ. Es startete 2018 und endet 2020. Es stellt die Fragen, was sind die Diskrepanzen zwischen Guidelines und Realität, in wie fern sind die Erfahrungen von jenen Betroffenen anders, die in spezialisierte Zentren betreut werden von den, die nur eine unspezifische medizinische und therapeutische Betreuung geniessen? Das Projekt stellt auch die Frage, was sind die Unterschiede in der Erfahrung Britischen |
Ataxie-betroffenen in Vergleich zu den Erfahrungen Betroffenen in Frankreich und in einem anderen (noch undefinierten) Europäischen Land? Das Ziel ist, Unterschiede der Praxis zu vergleichen und zu bewerten, um festzustellen, ob sogenannte qualitativ hochwertige Gesundheitsversorgung sozio-ökonomisch gerechtfertigt ist, wie auch, was Lücken in der Betreuung für die individuelle Lebenserfahrung bedeutet.
Interessante und wichtige Fragen! Es wäre interessant wenn solche Forschung auch in der Schweiz durchführt würde: Macht es einen Unterschied ob Betroffenen in Kanton Aargau, eher als Bern oder Basel Stadt, wo die eigene Universitätszentren Kliniken sind mit einer spezialisierten Expertise? Führt die Situation je nach dem zu einer sehr ungünstigen Situation und Versorgung für jemanden mit einer seltenen Krankheit?
EURORDIS (Die Stimme Betroffener seltener Neuro-krankheiten in Europa)(Siehe: https://www.eurordis.org)
Cathalijne Van Doorne, (Cathalijne spricht man Kateleinaus) die selber von dominanter Ataxie (hereditär, spät-Beginn) betroffen ist und daher ex-Medizin-biologin ist, hat sich trotzdem entschieden, Präsidentin von EuroAtaxia zu werden , wie auch für EURORDIS - European Organization for Rare Diseases - Europäische Organisation für seltene Krankheiten- zu arbeiten. Gerade jetzt in März 2019, als ich bei Cathalijne nachfrage ob das, was ich zu ihrer C.V. schreibe, genau stimme, hat sie mir informiert, dass sie auch gerade zur Mitarbeiterin des Pharmacovigilance Risk Assessment Committee (Komitee zu Medikamenten-Überwachung und-Risikoanalyse) bei der European Medicines Agency (Europäische Medikamenten-Agentur) ernannt wurde.
Cathalijne steckt ihre ganze (ausser familiäre-) Energie in die Besserung von Beziehungen und dem Verständnis zwischen den verschiedenen Akteuren der Ataxie-welt.
| Cathalijne arbeitet an der Verbesserung der Wirksamkeit von Patient Boards in der Entwicklung von Produkten und Therapien. Sie hat erfolgreich gezeigt dass a) Patienten-vertretern von Anfang an in der Forschungs-zum-Produkte-prozess eingebunden werden müssen und b) es viel wirksamer ist, wenn die gleichen Vertretern konstant dabei sind, wie auch bei verschiedenen Boards gleichzeitig wirken. So wird ein kohärentes Bild wirksam vermittelt und die Kompetenz |
gesteigert.
Cathalijne stellt auch grundsätzlich die allgemeine Ziele der Ataxie-Forschung als Patientin in Frage. Sie hat sich schon im Europäischen Parlament Gehör verschafft in Bezug auf das Überdenken von Forschungszielen in der Entwicklung neuer Produkten und Arzneimitteln, und zwar zu Zielen, welche Patienten für wertvoll halten. Mit ihrer direkten und menschlichen Art Botschaften zu überbringen, hat sie sich mit einemAuftritt einen Namen in der europäischen Pharma und Forschung gemacht.
Für einen Patient, sagt Cathalijne, ist es viel wichtiger mit den Kollegen, Freunden und der Familie - Partner, Kinder, Enkelkinder – deutlich kommunizieren zu könnenund so an der sozialen Welt einschränkungslos teil zu nehmen, als ein Paar Schritte laufen zu können. Oft sind es junge Leute in einem Alter, in dem sie noch nicht begriffen haben, was wirklich zu ihrer Isolation führen wird, die von Forschenden oder den Pharmakonzernen konsultiert werden über wünschenswerte Ziele für neue Produkte. Als junger Mensch glaubt man oft, dass mit einem Rollstuhl rumzukommen zu müssen wäre eine schreckliche soziale Abstieg. In der Realität ist die soziale Isolation, die durch die immer-weiter-sich-reduzierende Kapazität klar zu reden und zu kommunizieren bewirkt wird, viel Lebenseinschneidender als in einem Rolli zu sitzen (wie der Fall vom Politiker Edmund Schäuble zeigt!). Also wäre verbesserte mündliche Kommunikationeine wertvolle und wirksame Forschungsziel für Trials. Warum ist die Messungs- und Erfolgslatte bei Trials so oft die Fähigkeit noch drei Schritte laufen zu können? Eigentlich ist es auch so, dass für viele Trials die Qualifizierung zur Teilnahme par excellenceist, ob man schon im Rolli ist … und wenn ja, vergiss es! So, kommentiert Cathalijne, So werden wir die Lebensqualität neurologisch-eingeschränkter Menschen kaum verbessern!
In Übrigens, Cathalijne führt einen interessanten und auch lustigen Blog auf Holländisch: http://ataxie-adca-sca.blogspot.com Auch wenn man es nicht ganz versteht, lohnt es sich das anzuschauen…
Fortschritte und Aktuelles in der Arzneiforschung
Das Projekt NICOFA
NICOFA –Nicotinamide in Friedreich Ataxia- steht für Forschung mit Nicotinamid zur Verbesserung der Lebensqualität von Patienten mit Friedreichscher Ataxie. Diese Forschung läuft seit einiger Jahren: die klinische Versuche sind weit vorangeschritten.
Die Trials indizieren signifikante Ergebnisse und mit grösster Wahrscheinlichkeit werden Patienten in den kommenden Jahren unter ärztlicher Begleitung offiziell davon profitieren können.
Das Projekt wurde von Prof Richard Festenstein am Imperial College London vor einigen Jahren begonnen, wo auch dann erste klinische Trials durchführt wurden. Jetzt leitet und koordiniert Prof Jörg B Schulz vom Uniklinik Aachen aus, fortgeschrittene klinische Versuche in mehreren europäischen Ländern (Phase III Trials, 225 Erwachsene FridA-betroffenen darunter 50 auf Placebo).
Was ist das Projekt?
Das Projekt hat als erstes Nicotinamid, ein bestimmter Form von Vitamin B3, als mögliches Mittel zur Behandlung der FridA-Symptomen identifiziert Seitdem werden klinische Trials – Phase I: Human Safety Trial (Menschliche Erträglichkeits-versuch) Phase II: Human Safety and Efficacy Trial (Menschliche Erträglichkeit und Wirksamkeits-versuch) wie Phase III: Definitive Trial (definitive Versuche) – unternommen.
Was ist der Ursache von FridA Symptomen?
Wir wissen heute, dass beim FridA es beim GAA-Allel - das Frataxin-Gen -zu einer Mutation kommt: Das GAA, im Form von Nukleosomen, ist manchmal bis zu zweitausend Mal wiederholt (auf Englisch, GAA Repeat) und wickelt sich um sich so, dass das Gen seine Aufgabe nicht richtig erfüllen kann. Sokann Frataxinnur in geringeren Mengen produziert werden. Wir brauchen aber stets genügend Frataxin. Ohne Frataxin fehlt es dem Körper an Energie für den Aufbau und Unterhalt: Die Organe wachsen und funktionieren immer wie schlechter. Kurz gesagt, es ist der geringe Ausdruck von Frataxin (low Frataxin expression), der verursacht, dass im Körper und den Organen von FridA-Betroffenen mit der Zeit immer weniger gut funktionieren und warum FridA-Betroffener weniger Energie haben, als andere Leute.
Was ist Frataxin?
| Frataxin ist ein wichtiges Protein oder Eiweiss, das in jeder Zelle des menschlichen Körpers bei der Energieproduktion mitwirkt. Frataxin ist in den Mitochondrien situiert und ist ein sogenannte Iron Chaperone, oder Eisen-Begleiter – nur in Begleitung von Frataxin können die Mitochondrien Eisen im Körper in der richtigen Menge transportieren. Die Mitochondrien selber sind die Lieferer von Frataxin-Eisen |
zu jeder Zelle. Eisen ist, wie jeder weiss, für gesunde Blut und genügend Energie unerlässlich. Ohne genügend Frataxin kann das Eisen nicht angemessen transportiert werden und beim warten auf Transport degradiert das Eisen sogar: Es oxidiert. Nicht nur wirkt das Eisen nicht angemessen ohne Frataxin, es klaut auch noch zusätzlich Sauerstoff, das für körperliche Performanz nötig wäre!
Wozu führt die Steigerung von Frataxin beim FridA-Patienten?
Bei der Steigerung von Frataxin in den Mitochondrien bekommen das Blut und die körperliche Organe mehr Energie. Diese kann über Zeit eine Reduktion der FridA-Symptomen bewirken, wie auch zu mehr Ausdauer führen.
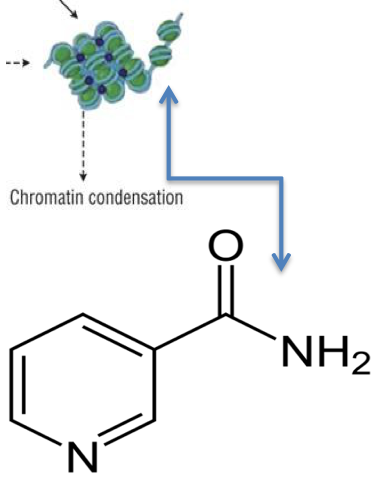
Warum Nicotinamid?
Nicotinamid wirkt zur Steigerung der Ausdruck von Frataxin im Körper.
Wie wirkt Nicotinamid?
Nicotinamid wirkt direkt im genetischen Helix. Wie vorher gesagt, ist das GAA Allel (in Form von Nukleosomen) überflüssig wiederholt, was funktions-behindernd beim FridA-betroffenen wirkt. Die vielen Wiederholungen umzingeln sich eng aneinander gereiht und dies nach einem bestimmten Ordnungsprinzip, das von Chromatin-Histon strukturiert wird. Histon ist ein hochalkalisches Eiweiss und bildet den Haupteiweissanteil vom Chromatin. In höheren Dosen wirkt Nicotinamid schwächend auf das Chromatin-histon, so dass das ordentliche Umzingeln der Wiederholungen aufgelöst wird. Dies befreit das GAA und erlaubt, oder macht die Produktion von mehr Frataxin möglich.
|
|
Das untere Teil vom Bild zeigt Links wie all die GAA Wiederholungen beim FridA-Betroffenen eng an einander gepackt sind in sog. Nukleosomen.
Das grüne Teil Rechts zeigt im Nah-bild wie die GAA durch die ordnende Einwirkung des Chromatin-Histon in engen Nukleosomen gespult sind.Das Nicotinamid wirkt auf das Chromatin, das Nukleusom wickelt sich als Seil ab. So können die GAA-Nukleosome ihre Arbeit aufnehmen und Frataxin produzieren. (Bilder Euro-Ataxia-Nicotinamide-Update-Schulz powerpoint2018)
Was für Änderungen bewirkt Nicotinamid beim Betroffenen?
Die klinische Versuche in London zeigten schon eine steigende Verbesserung der SARA scores (Scale for the Assessment and Rating of Ataxia) und modifizierten FARS (Friedreich Ataxia Rating Scale), wie auch den Eindruck, seitens des Arztes wie auch von Seiten der Betroffenen, einer globalen Verbesserung. Eine Verbesserung der Koordination, der Motorfunktion, besonders der Augen und beim Sprechen, wie auch eine Besserung der Kognition, Reflexen und Alltags-fähigkeiten wurde festgestellt, wie auch eine Besserung des Gehens bei denen, die noch laufen.
Was ist Nicotinamid und ist es sicher?
Nicotinamid ist ein spezielle Formvon Niacin oder Vitamin B3. Es wird oral täglich eingenommen. Während des Aufbaus der Trials (insgesamt 552 Betroffene) wurde die Dosis langsam erhöht und individuell optimiert. Es gibt Nebenwirkungen: vor allen Errötungund Brechreiz, was dazu geführt hat, dass schon während der Versuche einige Probanden ein Antiemetikum bekommen. In einige Fälle führt die Einnahme zu erhöhten Leberwerten. Wie oft das der Fall ist, ist es unterschiedlich wie Individuen eine Arznei vertragen. Die einen vertragen sie gut, andere tolerieren sie weniger. Es gab Probanden, die ausgestiegen sind. Die Trials werden aber als erfolgreich eingeschätzt und der Prozess geht weiter. Bei der Präsentation von den MOXIE Trials (Siehe unten) wurde gar nicht auf die Nebenwirkungen eingegangen. Was klar ist, eine Einnahme von Nicotinamid muss durch Titration (langsame Steigerung der Dosis) individuell angepasst werden und wird in ärztlicher Begleitung unternommen.
REATA und die MOXIE Trials
REATA ist eine kleine pharmazeutische Firma in Dallas Texas, die nur zwei Projekte bearbeitet, eines davon für FridA: Das Omaveloxolone (Omav) oder RTA-406 Projekt mit Branding als MOXIE. Kara Eichelkraut, Senior Manager for Patient Advocacy bei REATA kam um vom Stand der Dinge zu berichten.
Der Wirkstoff „Omav“ wurde als Orphan Drug in Juni 2017 vom FDA (US-Drogenbehörden) designiert. Somit ist der Frage der menschlichen Verträglichkeit grundsätzlich abgeschlossen. Mit dem Brand-Namen MOXIE wird dieses Arzneimittel in Phase III Trials momentan in den USA und der EU getestet.
|
|
Wie wirkt MOXIE?
MOXIE wirkt auch auf das Frataxin, aber anderswo als Nicotinamid - nicht im genetischen Helix sondern direkt bei den Mitochondrien in den Zellen (Siehe oben Was ist Frataxin?wie das Frataxin als Eisen-begleiter in den Mitochondrien wirkt).
MOXIE wirkt bei den Mitochondrien um oxidativer Stress zu reduzieren – in der Laiensprache vermindert MOXIE das Rosten des Eisens und damit befreit es, in Begleitung von Frataxin wirksam im Blut mitzuspielen. Das Frataxin selber wird nicht erhöht.
In FridA ist ein bedeutender „Sauerstofffänger“ der Nrf2 pathway (Nrf2 Weg). MOXIE kann diesen Defekt reparieren.
Was für Änderungen bewirkt MOXIE beim Betroffenen?
Zuerst muss gesagt werden, dass für die MOXIETrials im Versuchskohort nur Patienten akzeptiert wurden, die noch mindestens mit Unterstützung die Fähigkeit zum Gehen demonstrieren.
Die Versuche haben in einem ersten Schritt eine optimale Dosis der Arznei in Bezug auf „acceptable adverse events“ (akzeptable unerwünschte Ereignisse) einerseits (keine Details hierzu) und Wirksamkeit anderseits festgelegt (80-160mg pro Tag). In einem zweiten Durführungsschritt über 48 Wochen wurden bei einem Kohorte von 100 Teilnehmenden Verbesserungen der metabolischen und mitochondriellen Funktionen, wie auch eine Zunahme der Kapazität für physische Übungen, und der neurologischen Funktion gemessen. Die Auswertung wird Ende 2019 erwartet.
Angenommen die Versuche demonstrieren ausreichende Wirksamkeit, so wird der nächste Schritt ein NDA Filing sein - ein New Drug Application Filing, der Antrag auf Zulassung, so dass die Produktion und Vermarktung etwas länger dauern wird als bei Nicotinamid. Da MOXIE-Versuche jedoch auch in Europa (EU) geführt werden, wird die EU etwa gleichzeitig wie die USA davon profitieren. Die Schweiz wird auf Swiss Medics eigene Segnung warten müssen, bevor Betroffenen von Ärzten MOXIE verschreiben werden können.


 Cathalijne van Doorne, Präsidentin von Euro-Ataxia und EURORDIS und Prof. Dr. Jörg Schulz bei seiner Präsentation der NICOFA-Projekt in Frankfurt 9.11.2018 (Bild Suni Christie 2018)
Cathalijne van Doorne, Präsidentin von Euro-Ataxia und EURORDIS und Prof. Dr. Jörg Schulz bei seiner Präsentation der NICOFA-Projekt in Frankfurt 9.11.2018 (Bild Suni Christie 2018)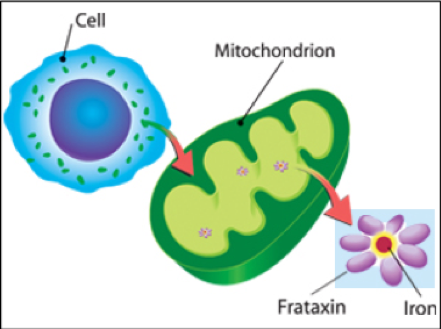 Das Bild zeigt rechts Frataxin-Eisen-Bündeln (Frataxin-iron clusters). Sie befinden sich innerhalb der Mitochondrien, welche für Energie-zufuhr in sämtlichen Humanzellen verantwortlich sind. (Bildquelle Euro-Ataxia-Nicotinamide-Update-Schulz powerpoint2018)
Das Bild zeigt rechts Frataxin-Eisen-Bündeln (Frataxin-iron clusters). Sie befinden sich innerhalb der Mitochondrien, welche für Energie-zufuhr in sämtlichen Humanzellen verantwortlich sind. (Bildquelle Euro-Ataxia-Nicotinamide-Update-Schulz powerpoint2018)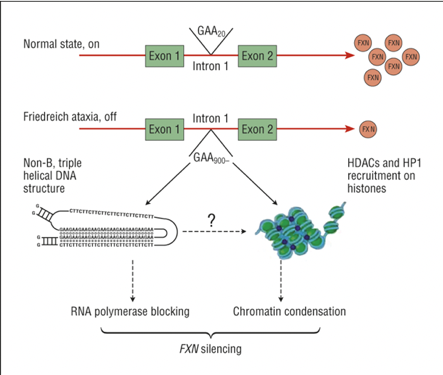
 Kara Eichelkraut, Senior Manager for Patient Advocacy, REATA, (rechts) präsentierte der Stand der MOXIE Trials
Kara Eichelkraut, Senior Manager for Patient Advocacy, REATA, (rechts) präsentierte der Stand der MOXIE Trials